Images Collection
View this article in Search Friendly Plain Text
NOTE: This plain text article interpretation has been digitally created by OCR software to estimate the article text, to help both users and search engines find relevant article content. To read the actual article text, view or download the PDF above.
jSonderabdruck: Helvetica Bhysiologica et Pharmacologica Acta, Vol. 12, Fase. 4,1954 ‘ K iHEely. Physiol. Acta 12,. 327-337 (1954)
AuJ^pS Pharmakologischen Institut der Universität Bern
Ein biologischer Hachweis von Adrenochrom und seine mögliche Anwendung1
Von P. N, Witt fw^Eing^^men. aEm 4. Dezember 1954 Abbildungen)
Hypothese vertritt,. daß Geisteskrankheiten oder akut auftretende Delirien durch Substanzen werden, die unter patho-
logischen Bedingungen im‘l®fp^des Kranken neu entstehen, oder sich zu wirksamen Konzentrati^^^anreichern, kann man alle Substanzen verdächtigen, die zwei erfüllen: Erstens erzeugen sie delirien-
ähnliche Gesunden, und zweitßÉbj kommen sie tatsächlich im
Die erste” *¥orèul§%tz|^^^IMfe alle Substanzen, die der Gruppe der sogenannten Phantastioa {Lewin juj) oder halluzinogenen Substanzen {Hoff er u. MitarMpi)|âh’gehören. Die zweite Voraussetzung hält man im allgemeinen für èrfüMt,, wenn die halluzinogenen Substanzen in ihrer Struktur einer Körpemu%|8m^^^^gEB|||^pNp^ Aus diesem Grunde wurde Mescalin oder 3,5-DijM^^^^ffiMy-^-phënäthylamin als §|p^Äs Amin von JatzJce-witz und NffèÈÈë $3) Verdächtigt; dhg^pi war BlicJcensdorfer (4) der Haupt-verfÄ^potheser d^^epgsäurediäthylamid (LSD) trete mög-^i^Äwßisè).,;im Körper auf; Mste^lich fanden Hoffer,
Osmond un, daß Adrenochrom hallifeiiiögen wirkt, .und,ent-*fpfpel4eh. daral|p|e HygèÄ^p, daß ,^r>fehlgel^ei^P^[|ermentati’|&Abbau des Adrenalins. iki Kö*er zja^einer+>Anr^cherung dieser Substanz führen könnte fund’ damit^d^^^^^^pMärtß . Bei keiner dieser oder anderer verdächtiger Substanzen kè]öje;aber bisher nachgewi^sen werden, daß sie tatsächlich ifflj Körper auftr,etenrf>
In anderen Labdfhtorien wollte man das Problem! von der andern Seite her angreMen: Mln versuchte nachzuwei||n, daß in den Körperflüssigkeiten oder Ausse^y^^Ä^der Kranken Substanzen^ Vorkommen, die bei Gesunden nicht naoBfeeiseh end wollte man dte^ekßubstanzen dann
identifizieret! Die Pro^lmatik des Vorgehens ist einleuchtend: man tastet so lange auf gut Glück umher, man einen Unterschied in der biologischen
ylM^^Dhirchführtmg der ArT^emf be’sohâ’é^ssâ’é^’ umfangreicben Messungen, war nur dadur%3B)«^l^fc}^^dâBrièh die M^Mrstützung des ETationalfonds, Forschungskommission der Universität Bern, erhielt, wofür ich hier noch einmal danke.
328
OH
P. N. Witt
CH,
I
o
CH,
OH
UH3 ^,XN^CH-HC1 ‘\ch3
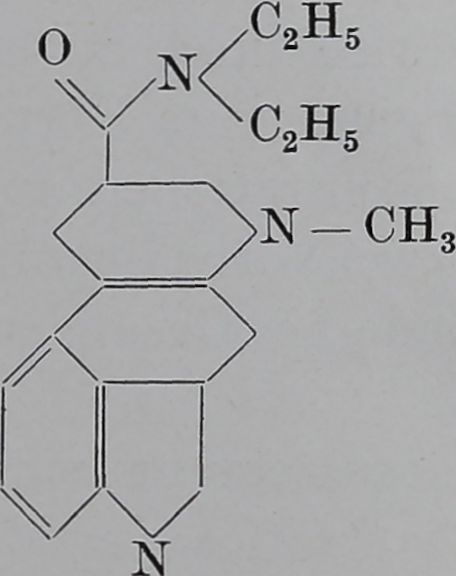
Substanz HI
CH3
■
O yCHo
o
I H2
WMm H ci
■Bhl.
H,
M’esccâin
O
OH
_/
<N—\ Adrenochrom
H2
/Cx HC1 CK \NH2 H,
Dijod-methoxy- ß-phenäth ylamin

d-Lysergsäurediäthylamid
oder chemischen Reaktion zwischen den Flüssigkeiten von Gesunden und Kranken gefunden hat. Dann versucht man durch Fraktionierung unter ständiger (meist biologischer) Kontrolle die verdächtige Substanz anzureichern und schließlich von allen Begleitstoffen zu trennen. Von den Versuchen in dieser Richtung ist einer der erfolgreichsten der von Georgi u. Mit-arb., j£onnt|f|dh§fe dieser Autoren, Rieder (5), doch mit Hilf^
der Messung der Hefeatmung den ersten Schritt tun, nämlich den Nachweis eines Unterschiedes zwischen dem Urin Normaler und i§|hizophrener bringen.
Wir machten mfuns zur Aufgabe, die Wahrscheinlichkeit all der aufgeführten Hypothesen* zu überprüfen» Auf Grund der Empfindlichkeit einerseits, und des Differenzierungsvermögens zwischen mehreren haHuzinÖ]gehen Substanzen anderseits, schien mir der Spinnentest die Möglichkeit zu bieten, kleine Mengen der oben aufgeführten Substanzen biologisch nachzuweisen. Dieser Test, der 1949 von Peters und mir eingeführt worden ist,(6), ist seither unter anderem auf seine Empfindlichkeit gegen Mescalin und 3,5-Dijod-4-t Methoxy-/?-phenäthylamin (7) und LSD (8) geprüft worden. Es blieb nun
Adrenochrom im Spinnentest
329
di|jÉmpfindlichkeit gegen Adrenochrom zu prüfen, um den nächsten Schritt, die Prüfung der Körperflüssigkeiten, gründlich vorzubereiten. In der folgenden Arfe|t-herlchten wir über Erge^Mä^ bei der Verabfolgung von Adrenochrom undtch.emiseh ähnlichen Substanzen an Spinnen.
Methodik
Die Durchführung des Tests ist von Peters, Witt und Wolff (9) und von Wolff und Hempel (10) beschrieben worden! Folgendes Vorgehen wurde,bei den hier beschrie-behel^i^suchén angewandt.
Die ‘Spinnè Zilla-x-notäta CI. wird in der Eckè eines Holzrahmens von -35 ,X 35 cm IMieihem.-Papierthtchen amgesiedelfë Das in den Rahmen gebaute Netz wird täglich zerstört, die Netzbauhäufigkeit durch eine kontrollierte Fliegendiät so eingestellt^ dayman* mit Ausnahme der Häutungsperioden, (etwa 5.Tage Unterbrechung) täglich ein neues Netz erhält. Das neue Netz, das in den frühen Morgenstunden gebaut wurde, wird am Vormittag mit Ammoniumchlorid leicht beräuchert und dann bei seitlicher Beleuchtung • vör einem dunklen Hintergrund proportionsgerecht photographiert. ;^®i^Negativ (wiEd durch Projektion auf die. ursprüngliche Größe gebracht, worauf in-.sMfee%;einzelnen Proportionen vermessen wird. Da das Photographieren tägli^^^lhdglit, hat man tèin.è Kontrolle über die normale Variation des Netzbaues v®s Individuums, und die Substanz Wirkung hebt sipb deutlich däyon ab.
T I)ie Anplikatiö^dfer..Substanz erfolgtem wässeriger Lösung per os, wobei Zucker als%Geschm,adk^^rrig^s(zugese^iwird. Aus der relativ konstanten Trinkmenge (10)
‘ un£der Konzentration, der Lösung errechnet sijeshl die aufgenommene Dosis. Da die ^^etzbauzeit feststeht, läßt sich durch Änderung der Applikationszeit feststellen, wann diélJSubstanz den Höhepunkt der Wirkung entfaltet. Nach den Ergebnissen von VorversuchenksMi^^^^H günstigsten, diiÄpplikation aller Substanzen zu zwei verschiedenen Zeiten vorzunehmen. Wir wählten 17.30 u^aT22.30 Uhr (mit Verschiebung gegen Ende des Sommers, entsprechend der festgestellten Verschiebung der Netzbauzeit), was bis zum Netzbau eine Einwirkungszeit von 11—13 bzw. 6-8 Stunden ergibt.
Folgende Proportionen im Netz wurden bei dieiifn Versuchen gemessen (wegen der Bézbichüung’der einzelnen Netzteile siebe Abb. 1):
1. Die Netzgröße, Ke planimetrisch durch Umfahrén entlang dem äußeren Spiralumgang festgestellt wird.
^’Afipas’Verhält^^von Länge zu Breite der Eangfliehe, das #Js senkrechte und wiagr^c&ë ÄèÉlfe der vom äußeren Spiralumgang begrenzten Fläche g’èihësäen wird.
3. Die Winkelregelmäßigkeit,• diesis aus den Differenzen der
Größe der von Radien eingeschlosseüen Nachbarwinkel ringsherum gebildet wird.
4. Das Auftreten übergroßer Sektoren (dies sind solche Winkel zwischen zwei benachbarten Radiefj^ die größer als die Summe ihrer Nachbarwinkel saf).
ivd^Die Lage der Nabe im Netz, die durch Verlängerung des Signalfadens Schlupfwinkel über die,Nabe (a) zum gegenüberliegenden äußersten Sp’ralumgang (b) gemessen und als.^/b berechnet wird.
25 Helv. Physiol, Acta 12,1954
330
WSM1
‘ O. Ii^fâfeziBlnen Fällen wird die Regelmäßigkeit der Spirale durch Bildung des Mittelwertes aus den Differenzen der Abstände der Umgänge entlang einem Radius bestimmt.
7. Dië4 Netzbauhäufigkeit wird derjenigen unbeeinflußter Spinnen ^»selben Tagfestgestellt.
Einzelheiten der Mel thode können in deh oben zitierten Arbeiten nachgelesen werden.
Um die inter-individuelle Streuung auszuschalten, wurden die Netze desselben Tieres vor und nach Substanzgabe miteinander verglichen. Dies geschah durch Bildung der Differenz beider Werte, die bei unbeeinflußten Tieren um einen Mittelwert Null normal verteilt sind. Die Differenzen wurden also mit dem “theoretischen WerV i§ull Étit Hilfe des T-Tests verglichen. |Éjt Linder (11) nehmen wir ein Ergebnis nur dann als gesichert an, wenn das T .über dem Wéjctë für P 0^01 liegt. Da és.aber möglich ist, daß in einzelnen Fällen. nur efiÉk rian VerB^thas zur Größe der Streuung zu kleine Versuchszahl^^Mi’lft, hab^ffiwir die Mittelwerte zur Orientierung in einer Tabelle zusammengefaßt und auch die^^sa@^^|SpÉ^^j^9ferte (zwischen P 0*05 und 0j|l) in der Tabelle markiert:
Das verwendete Adrenochrom verdanken wir Herrn Dr. Hirth von der Firma Dr. A. Wander, |fein, ebenfalls d|&jals HI bezeichnete und mit der Formel gezeichnete Substanz; Adrenoxyl, das Seimeärbääon des Adrenochroms, «WEwBi wir von der Firma Labaz S.A., Brüssel (die Lösungen 0,2L.x, 10~2waren gesättigt) j ^fer verwendeten wir das Nembutal Söditim dèr Abbot Laboratöriel^ –

Abb. 1. Normales Netz vonZilla-x-notata mit Bezeichnung der einzelnen jjfeiBgaHBBHHPhotographiajVt.
Ergebnisse
Die ersten Versuche mit Adrenochrom’einer relativ «Ëéh Konzentration H 0~2 per osBlla. 40m[^ubstanz/fer])MpK^m 11 :%inn#i^|die drei überlebenden bautëÉian nächsten bzw. übernächsten Tag wieder iffepll. Die Verdünnung ca. 16^Substâh#/fi^)(alle 5* Versuchstiere. Eine weitere Verdünnung 10“2! = caBRjM Snbltäniz/Tier)
Adrenochrom im Spinnentest
331
tötete eines von 5 Tieren, ein zweites baute einen Monat lang kein Netz mehr. Bei der Verdünnung IO“3 ® ea. 4 y Substanz/Tier) starb von 33 untersuchten Spinnen keine. – Die tödliche Dosis führte zu einer tiefbraunroten Verfärbung der règlos in ihren Schlupfwinkeln sitzenden Tiere. Der Tod erfolgte erst im Laufe der Nacht; niemals zeigten sich Zeichen der Vergiftung direkt nach der Applikation. Mit «Adrenochrom alt» bezeichnen wir eine Adreno-chrom-Zucker-Lösung, die 24 Stunden an der Luft gestanden hat und deren Farbe schmutzigbraun und Beschaffenheit trübe ist (dié frische Lösung ist klar bordeauxrot). Diese Lösung IO“2 verfüttert ( = ca. 40 y/Tier) ergab bei 10 Tieren kein totes.
Um einen Vergleich mit der Toxizität am Warmblüter zu erhalten, wurde 10 durstigen weißen Mäusen von durchschnittlich 20 g Körpergewicht je 10 mg frische Adrenochromlösung per os gegeben, was 9 überlebten. Dagegen töteten 10 mg frisches Adrenochrom/Tier in wässeriger Lösung i.p. injiziert 7 von 8 Mäusen nach anfänglichen Krämpfen innerhalb von 10 Minuten; 1 mg/Tier tötete keines von 7 Tieren. Die Kontrollen wurden mit der gleichen Menge Wasser gespritzt, und nur ein Tier starb. 10 mg/Tier Adrenochrom in 24 Stunden alter Lösung i.p. verursachte keine Krämpfe und tötete 1 von 8 Tieren; 1 mg/Tier altes Adrenochrom zeigte keine Wirkung bei 8 Tieren. Der Unterschied zwischen der Wirkung i.p. und per os applizierter frischer Adrenochromlösung 10 mg/Tier H 0,5 g/kg) ist mit %2 = 7,4 stark gesieferf;, der Unterschied zwischen Adrenochrom alt und frisch i.p. ist mit j£2iB 6,25 bei P 0,01 6,6 schwach gesichert.. :
Uber die Ergebnisse aller- Versuche an Spinnen mit nicht-tödlichen Dosen gibt Tabe3||’ 1 Auskunft. Die fettgedruckten Werte konnten gegen die Leerwerte als verschieden statistisch stark gesichert werden; die mit * be-zeichneten Zahlen sind schwach gesichert von der Norm verschieden (siehe auch Methodik).
Tabelle 1
Mittelwerte aus allen Versuchen mit einer Substanz, verglichen mit den Mittelwerten der unbeeinflußten Netze der^^mlÄlla Individuen. Die fettgedruckten Werte weichen von den Leerwerten statistisch stark gesichert, die mit * bezeichneten schwach gesichert ab. Weiteres siehe im Text.
| Substanz ‘. | Konzentration | Âpplikat. Std. vor Netzbau | im folgenden Tag | |||||||
| Netz-bau-häufig-»keit % | Vermehrg.
übergroßer Sektoren |
Größe
(cm2) |
LSnge/
Breite |
Winkel
regelm. |
Spiral
regelm. |
Naben-
synun. s* |
Zahl
der Netze |
|||
| Ohne * | 85 | 0,29 | 312 | 1,41 | 1,93 | 0,78 | 0,061 | 131 | ||
| Adrenochrom | IO“2 | 6t-8 | ’ 55 | ‘ 0,25 “ | 163 | 1,42 | 2,93 | 0,70 | 0,158 | 21 |
| Adrenochrom | IO“» | 11-13 | 50 | .0,33′ | 222 | 1,46 | 2,32 | 0,98 | 0,075 | 12 |
| Adrenochrom alt. | IO”3 | 6-8 | 50 | 0,50* | 154 | 2,26 | 4,46 | 0,63 | 16 | |
| Adrenochrom alt | IO”3 | m-13 | 58 | . Bl | 201 | 1,45 | 3,59 | 0,095 | 19 | |
| Âdrenoxyl | o,$xio-3 | 6-8 | 62 | 0,25 | 196 | 1,42 | 2,11 | 0,1025 | 13 | |
| Adrenoxyl | O,0kJlO-2 | 11-13 | 62 | 0,325 | 187 | 1,49 | 2,96 | 0,0565 | 13 | |
| Nembutal | 10-2 | 6-8 | 62 | 0,69* | 180 | 1,50 | 2,01 | 0,1070 | 22 | |
| Nembutal | IO“2 | 11-13 | 50 | 0,50* | 155 | 2,55 | 2,83 | 0,274 | 12 | |
| Substanz HI | IO’2 . | 11-13 | 73 | 0,19 | 304 | 1,48 | 2,41 | 0,071 | 11 | |
332
P. N.Wttt


Nabensymm. 0,68 1,56 0,95 * .At T, 0^2
Winkelregel –
mäßigkeit ■ – 7,12 – / jX »4rr>■ ?3.19
Winkelregelmäßigkeit 2,20 3,60 2,24 1,60.
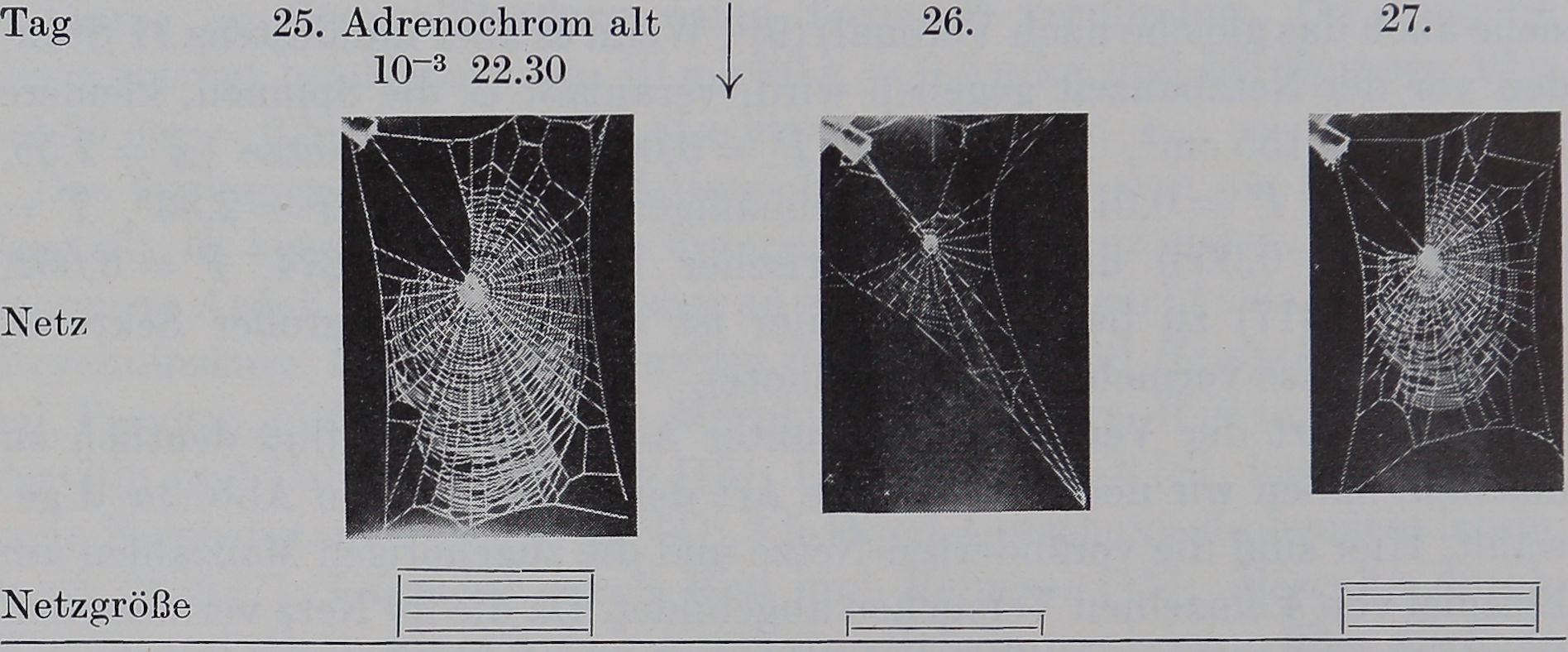
Sv Adrenochrom I • -.IO”3 22.30 ^
Netz
Nâb^^pjMTn. ,;;0,54
0,71
0,70
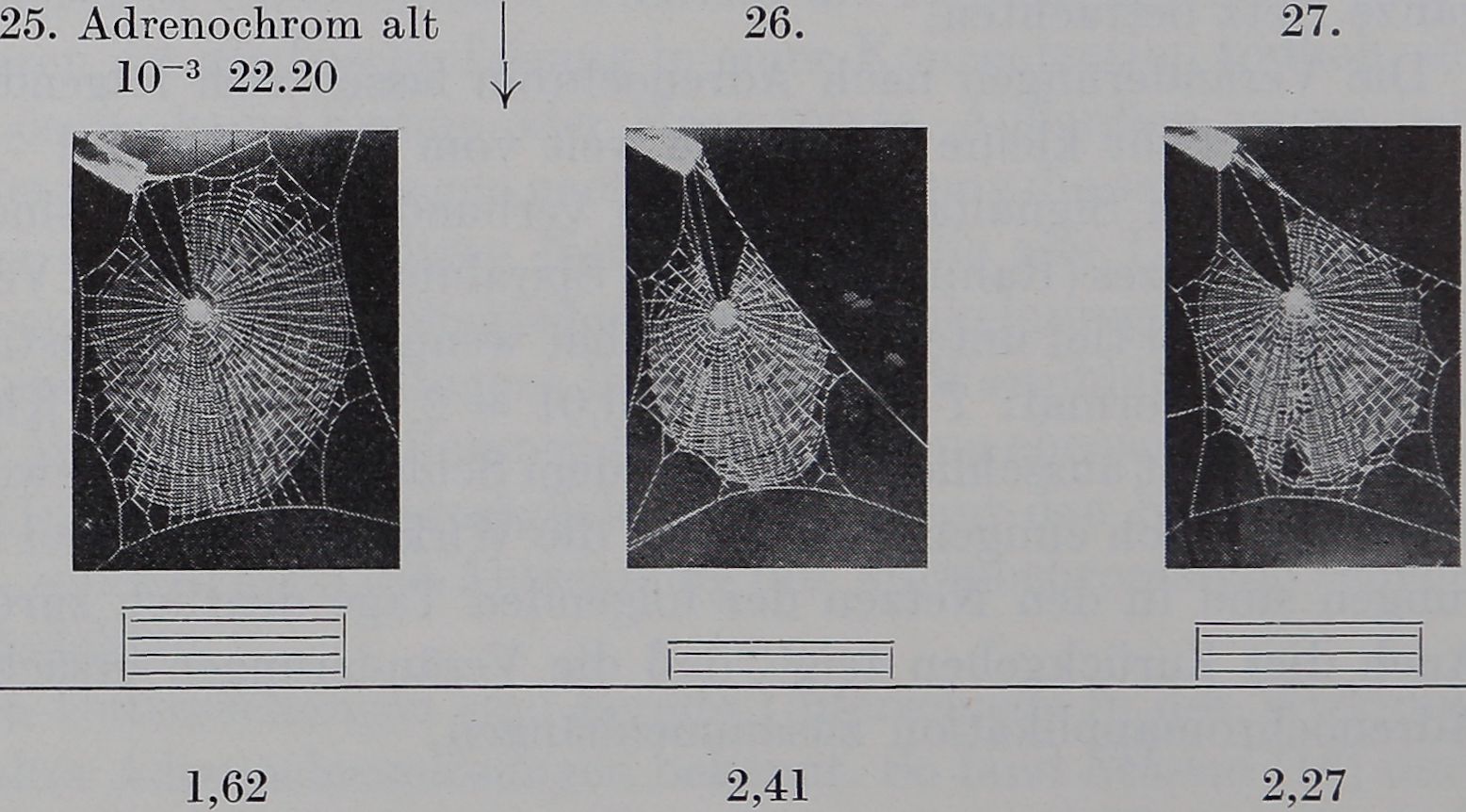
Tag 5. Adrenochrom
10~3 22.30
Netzgröße
Netz
In Auswertung von Tabelle 1 folgendes :
Frische Adrenochromlösung 10“3 beeinflußt den Netzbau deutlich, wenn*; den Spinnen weniger als etwa 10’Stunden vor der NetzbauBl gegeben wird; es treten kleinere Netze- (x = 163 cm2, pB 4,6776, pH^Ö02)>mdfeÉspé# metrischer Nabe = 3,923, P 0,01 = 3,23) auf. Früher’^
geben, äußert sich die Adrenochromwirkung nur – ater an^m^Ne^zgroße (A^22 cm2, T =, 4,4196j P^BË,O*02), o||ensi©fflaFe^pinem Symptom von geringer Spezifität. Alte Lösung verhält sich in bezug auf Wirkungsdauer (6-8 Stunden), Netzgröße (®t^ l54 èin2, T = 4,4689, P = 0,0625)f %nd Nabensymmetrie (s2 = 0,63, F= 3,878, P 0,0113,474) wie frische Lösung,
Adrenochrom im Spinnentest
333

Winkelregelmäßigkeit 2,36 9,50 –
Mibensymm. 1,01
1,48
1,14
H
Netz
Netzgröße
Winkëlregel-
mäßigkeit

Nabensymm. 0,74 . 0,90 0,83
Abb.2 a-d. bincS Individuums an’ drëffc^BaM^mufeinanderfolgenden Tagen,
^a^weit’ë Nëtz1 wurde Adrenochromapplikation gebaut. Beachte die
Unterschiede zwischen ‘d^rfr ersten und sgeitpn Netz auch in den darunter angegebe? nen Maßzahlen und die langsame Rückbildung derâeränderungen in den folgenden
V’ Tagen.
aber zusätzlich zeigt sich eine deutliche Zunahme der Unregelmäßigkeit der WinkelBH?46, TP = 0,007). Adremoxyl 0,2.x IO”2 bewirkt Netze* |p=^7 cm2, jPj^^8Jf, P = 0,0002). HI beeinflußt kelife der gemessenen Proportionen. Nembutal verursacht nach 6-8 Stunden kleinere Netze ,(MB^É)cm2, T — 4,6647, pH 0,0015) mit vermutlich einer’viéimehrten Zahl übergroßer Sektoren (%3.H4,5108, PO,05H i,8;
334
P. N. Witt
siehe auch das gleiche nach Veronal) (9)1. Wenn es aber mindestens 11 Stunden vor der Netzbauzeit gegeben wird, veranlaßt 7# die Spinnen, kleinere Netze (« = 155 cm2 * *, T = 3,4062, pB 0,004), länger^ Netzet’ppB 2,55, T =’.2,9850, P Bo,01) mit unregelmäßigeren Winkeln = 2,83f, T —
4,1941, P= 0,008) und asymmetrischer Nabe (SBB>274, jBsB,062, P OjOlB” 5,317) zu bauen. Auch hier ist die Zahl übergroßer Sektoren möglicherweise vermehrt (siehe Fußnote).
Um die Art der Veränderungen unter Adrenochromeimfluß dèiaipif zu machen, haben wir noch eine zweite Art der Darstellung in Abb. 2;a-d gewählt. Hier sind die veränderten Netze und die zugehörigen Maßzahlen am Beispiel von 4 einzelnen Versuchen abgebildet. Da 4% im Netz jjjÉl’ss’enen Proportionen nur eine willkürliche Abstraktion einer^GesamtveMnderung des komplizierten Ganzen sind,|äÜi®ii! wohl vorstellen, daß die verwendeten Maßzahlen nicht alle Veränderungen wiedergebën. Hingegen ist das menschliche Auge für geometrische Regelmäßigkeit, bzw. Abweichungen von dieser, sehr empfindlich (12). Deshalb soll man außer den Maßzahlen auch das ganze Netz betrachten.
Die Veränderungen nach Adrenachroijn lassestsihh SÜgendermaßc&v,^^ schreiben: Sehr kleine Netze, die weit vom Schlupfwinkel —jduröh eirreih relativ langen Signalfaden mit ilÉa, verbunden – gebaut sind. Der obere Rand des Netzes (Rahmenfaden und Spiraliu^Hwhegtim Verhältnis zum Schlupfwinkel tief unten. Das Jj|etzvhat wenig Radien (statistisch gesichert weniger als normal: T = 7,266, P
findet sich fast ausschheßlich an der dem Schlupfwinkel abgewendeten Seite der Nabe. Nach einigen StundebBt die Wirkung vorbei, und die Veränderungen sind in den Netzen der folgenden Tage1 ‘dfeuthcmzm^Kgegangen. Auch dies Zurückgehen zeigt, daß die Veränderungen ursächhch mit der Adrenochromapplikation Zusammenhängen.
Besprechung dct ‘
Die Ergebnisse zeigen eindeutig, daß Spinnen (und damit vielleicht wirbellose Tiere überhaupt) wie Warmblüter adrenochromempfindlieh sind. Das schnelle Abklingen der Wirkung kann nicht ^ul^Melaninbildung ‘im Körper beruhen, da dieses an Spinnen ebenfalls’ wirksam ist und ebenfalls schnell seine Wirkung verliert (Versuche mit altipLosung). Bei Warmblütern ist das Adrenochrom in der verwandten Dosis nur parenteral toxisch, während es per os im Gegensatz zu Spinnen nicht wirkt. Nichts kann darüber gesagt werden, ob es durch langsame Resorption oder chemische’Ver-
1 Wenn mehrere übergroße Sektoren nebeneinander auftreten, wird keiner in .der
Tabelle gezählt, da dann definitionsgemäß keiner größer ist als nie Summe seiner
ebenfalls übergroßen Nachbarwinkel. Dies kam mehrere Male in Nembutalnetzeti vor
und ist wahrscheinlich der Grund, daß die Unterschiede nur schwach gesichert sind.
Adrenochrom im Spinnentest
335
änderung im Warmblüterdarm seine Toxizität vermindert. Die tödliche Dosis beträgt bei Mäusen Lp. 10 mg/20 g = 0,5 g/kg und bei Spinnen 40 y auf 80 miJKD.5 g/kg per os^isst also, etwa gleich.
Das Wirkungsspektrum des Adrenochroms, wie. sich am Spinnennetz darstellt, ist keinem einer bisher untersuchten Substanz gleich. Da nur eine begrenzte Anzahl Substanzen bisher an Spinnen untersucht sind (Strychnin, Strychninsäure, Scopolamin, Pervitin durch Wolff und Hempel [10]; Veronal, Pervitin, Coffein, Thyroxin. Morphin durch Peters, Witt und Wolff [9]; Pervitin und Coffein durch Witt [13]; LSD durch Witt [8]; haschischwirksame Reinsubstanz durch Witt [14]; 3,5-Dijod-4-methoxy-/?-phenäthylamin durch Wlfl|7]; Largactil ^^jjWitt und Heimann [15]”, Mescalin durch Witt\*lf\ und alle in dieser Arbeit erwähnten Substanzen), kann über die Spezifität keine endgültige Aussage gemacht werden. Sie ist vorläufig nur als ausreichend? zu bezeichnen, um Adrenochrom von allen genannten, meist halluzinogenen Substanzen abzutrennen.
Adrenochromlösung frisch und Adrenochromlösung alt zeigen an Spinnen und Mäu^n deutliche Unterschiede: Während die Spinnen auf beide Sub-stahz^n reagieren, ist die frische Lösung in einer Konzentration tödlich, in der dié alte Lösung keine j^pinne oder Maus tötete. Außerdem zeigen bei Spinnen die MëtzbaSeränderungen nach frischer Lösung die asymmetrische Nabe in einbm^onst regelmäßigen Netz, während die alte Lösimg asymmetrische Naben in ganz unregelmäßigen Netzen (Winkelunregelmäßigkeit!) verursacht. Entsprechende Prüfungen liegen für den Warmblüter nicht vor. Die Dauer der Wirkung ist bei Spinnen bei alter Lösung ebenso kurz wie bei der frischen. Der Spinnentest ermöglicht also nicht nur den Nachweis vofc Adrenochrom, sondern auch die Abtrennung des Adrenochroms von seinen Zersetzüngsprodukten.
Aus anderen Untersuchungen sind bereits Unterschiede in der Wirkung frischer und alter Adrenochromlösungen bekannt. So fand Schmid (16) nur die braumgelb gefärbten alten Adrenochromlösungen am isolierten Vorhof des Meerschweinchens (Verlängerung der Adrenahnwirkung) und bei der Beeinflussung dill Wurzelwachistums der Gartenkresse (Krümmung der Wurzeln und mangelhaftes Einwachsen in die Unterlage) wirksam, während die frischen, reinen Adrenochromlösungen hier ganz unwirksam waren. Hoff er u. Mitarb. (2) glaubten am Menschen eine stark abgeschwächte Wirkung alter Adrenochromlösungen zu bemerken und gaben statt der zuerst wirksamen 0,‘5 mg/Person frischen Adrenochroms 10 mg altes Adrenochrom jjfev. mit etwa derselben Wirkung. Bacq (17) faßt alle Berichte über Adrenochrom zusammen, wobei er auf die große Wirksamkeit des frischen Adrenochroms als Wasserstoff carrier hinweist und die widersprechenden Berichte über alte Adrenochromlösung auf die je nach Oxydationsbedingungen in verschiedenen Mengenverhältnissen auftretenden physiologisch wirksamen Oxydationsprodukte zurückführt.
336
P. N. Witt
Daß Adrenoxyl außer einer (unspezifischen) Netzverkleinerung nickt auf den Netzbau der Spinne wirkt, kann nach den Befunden von Heymans und Charlier (18) an Hunden nicht verwundern. Die auftretende Netzverkleinel rung ist eher erstaunlich, wenn man denkt, daß#Jg?gënUaint èn Autoren 400 mg/1 als Blutersatz einem halbäns1^«ftllm Hunde-ohne Nebenwirkungen verabreichten.
Substanz HI ist die wenigst wirksame der geprüften ^ibstanzen. Dies scheint im Vergleich mit ihrer chemischen VerwandtS|pft; zum Adreno-chrom bemerkenswert.
Wieviel Adrenochrom können wir nun eigentlich mitp^S^SninneMést nachweisen ? Die Spinne reagiert auf 4 y Adrenochrom noch deutlich, ihr diese Meng« in 4 mg Zuckerwasser gereicht werden muß. Zum Nachweis brauchen wir (in Anbetracht der Streuung der Versuche und der Notwendigkeit, die Wirkung von anderen abzutrennen) etwa 20 Spinnen,
80 mg Flüssigkeit trinken. Es gehen dabei jeweilen kleinere Mengen in der Spritze und durch nicht-bauendie S^Srei^ve^^^M^P daß wir rechnen können, mit 0,2 ml AdrenochrorÈdë^p^^ IO-3 .einrBuberes Ergebnis zu erhalten. Mit den oben gemacht«^MShränkiingen iirbezug auf S, SpezifijBfc läßt it|h also 0,2 biologisch telftëm
Zusammenfassung
In vergleichender ^^®aHn<üng unid âlt^r5^pjrcnll|p)m-
lösung, Adreno]s^ Süib^^^^femd^^^l^tam^Ëppp^^^felP!^ß^00 % Adrenochrom in-Msche^É^i^-tod^Ba^l^TNfëng^ffeaM^fena^^ltcr Lösung genügt, üéct am ^iMèünetzb^mll^S^M^g zu werdfen^Die’ifsihh’^p? diesen Änd früheren
Spinnentests für die Überprüfung der Âdrenochromh^pßèhese’drë^^Mz’O-phrenie von HofferWmfßwd und Die Toxizit«des
Adrenochroms für ÉMÉ per os und für MäusM.p. pro ÉgiKörpergewiÄt .ist gleich.
ßympmry
Effects of the following drugs on the wéb-building behaviour of spiders were compared: Adrenochrome inifiish and old solutiph, Adrenoxyl, subs!” tance HI and Nembutal. As a resuItiB^’^hi^bpgrams.of-’AJrenochrome in fresh or old solution can be biologically identified in the web. The possibility of applying this test to the exneriméntaM^«stil?M^^fll^ Adrenochrome-hypothesis of schizophrenia by discussed.
The lethal dose of Adrenochrome applied oralhffl|ppllÈers equals the lethal dose applied to mice intraperitoneally.
Adrenochrom im Spinnentest
337
1. Lewin L.: Phantastica. Berlin 1924.
2. Hoff èr A\’^Osmond H. and Smythies J.; Schizophrenia, a new approach. II. Result of a year’s research. .!. Mental Science 100, 29-45 (1954).
3. Jjafakewitz H. und NoesJce H. D.: Synthese des 3,5-Dijod-4-methoxy-/?-phenäthyl-amins. É^^^^ëylers Zschr. Physiol. Chemie 287, 43-46 (1951).
4. iBlich’ënëtor^er^k: Zupa ätiologischen Problem der Psychosen vom akuten exogenen Reaktionstypus (Lysergsäurediäthylamid, ein psychisch wirksamer toxischer Spurenstoff). Arch. Psychiat. Z. Neurol. 188, 226-236 (1952).
5 . Rieder H. I\: (Gasstoffwechselversuche an Mikroorganismen mit Körper-, flü’säigk^ifen ’ Stammhirnaffizierter. gpbiyeiz. Arch. Neurol. 72, 387-393 (1953);
‘ Biologische Toxizitätshestimmung in pathologischen Körperflüssigkeiten. Con-finia Neurol.’ 14, 65-87 (1954).
6. Peters H. M. und Witt P. N.: Die Wirkung von Substanzen auf den Netzbau der
‘ ‘.Spirihén. ’Exper. 5,; I^i|^162: (1949).
7. Witt in Vorbereitung.
8. Witt P^fS-‘ d-Lysergsäure-diäthylamid im Spinnentest. Exper. 7, 310-311 (1951).
9. Pet&fë’-H. M., Witt P* N. und Wolff D.: Die Beeinflussung des Netzbaues der Spinnen durch neurotrope Substanzen. Z. vergl. Physiol. 32, 29-46 (1950).
10. Wolff D. und HempeliPJ.: Versuche über die Beeinflussung des Netzbaues von Zilla-x-notata durch Pervitin, Scopolamiü und Strychnin. Z. vergl. Physiol. 33, 497-528 (1951).
11 ^LirvdeHA. Methoden. BasëlöL951.
12. He’^WW. R.: Physiologische Grundlagen der Ästhetik. Helv. Physiol Acta 10, 462-468 (^^^3
13. Witt PlyM-.: Verschiedene Wirkung von Pervitin und Coffein auf den Netzbau der Spinne. Helv. Physiol. Acta 7, C 65 (1949).
14. Witt P. N.: Ein iialäches Prinzip zur Deutung einiger Proportionen im Spinnen –
. netz. Behaviour 4, 172-18fffef52):’.
U|| Witt P. N. und Heimann H.: Prüfung der Wirkung einer einmaligen Gabe von Largactil am Menschen mit dem Durchstreichtest von Meili und an der Spinne beim Netzbäuverhalten. Helv. Physiol. Acta 12, C 98 (1954).
16. Schmid W.: Zur biologischen Wirkung der Oxydationsprodukte des Adrenalins. Z. BiolY 105, 409-414 (1953),
17. Bacq Z. M.: |ffemetabolism of Adrenaline. Pharmacol. Rev. 1, 1-26 (1949).
18. Heymans G. et Gharlier P.:Recherehes expérimentales sur la monosémicarbazone
l’adrénochrome comme constituant d’unSU^^Mt du plasma sanguin. Arch.
. Pharmacodyn. 96. 105-12% (I953fe|^